
中国科学院解析哺乳动物大脑皮层和海马内源NMDA受体的组装和结构
IT之家1月26日消息,在人类大脑的微观世界里,有一类名为“NMDA”的神奇受体,它们就像嵌套在神经突触上的“分子开关”,掌控着学习与记忆等功能的神经信号传递,广泛参与神经发育、突触可塑性、认知及情绪等高级脑功能调控。
中国科学院脑智卓越中心的竺淑佳研究员团队成功从成年哺乳动物的大脑皮层和海马中提取NMDA受体,首次以原子分辨率将内源NMDA受体的三维结构呈现出来,并详细揭示了该受体的3种主要亚型及比例。
相关成果已于1月23日以《成年哺乳动物大脑皮层和海马内源NMDA受体的组装和结构》为题在线发表于国际学术期刊《细胞》上,由竺淑佳研究组和上海药物研究所李扬研究组合作完成。

研究团队通过提取大鼠大脑皮层和海马中的内源NMDA受体并解析出3种主要亚型及比例,揭示内源NMDA受体的原子分辨率三维结构,突破了NMDA受体的分子结构与功能研究局限于异源重组表达系统的瓶颈。该成果为开发靶向NMDA受体治疗神经或精神类疾病的新型药物提供了重要的理论基础。
学习和记忆是人类认知和感知世界的高级脑功能,突触可塑性的改变被认为是学习和记忆的物质基础。N-甲基-ᴅ-天冬氨酸(简称NMDA)受体是一类存在于突触上的离子型谷氨酸门控通道家族,广泛参与神经发育、突触可塑性、学习记忆、认知及情绪等高级脑功能调控,被视为学习和记忆的关键“分子开关”。NMDA受体在负责学习和记忆相关高级认知功能的脑区(如大脑皮层和海马)发挥着至关重要的作用,受体通道对钙离子具备高通透性,根据突触活动的强弱调控突触连接的强度,并参与下游信号介导基因的表达和新突触的形成。近年来的临床医学研究揭示NMDA受体功能障碍直接与一系列神经及精神疾病密切相关,包括NMDA受体突变相关的罕见病、癫痫、精神分裂症和自身免疫性脑炎等。因此,NMDA受体一直是脑疾病领域药物设计最热门的靶点,已有靶向NMDA受体的分子(如氯胺酮、美金刚、右美沙芬)用于临床治疗抑郁症和阿尔茨海默症。
在哺乳动物中,NMDA受体由7个不同基因编码形成7个不同亚基。有功能的NMDA受体通常由两个必需的GluN1亚基和两个可变的GluN2/3(N2A-N2D,N3A-N3B)亚基组装形成二异或三异四聚体。过去十年内,利用体外重组表达系统,NMDA受体亚型的结构与功能已被大量解析,其中竺淑佳研究组在该领域也取得了系列进展。然而,大脑中内源NMDA受体的亚基表达和受体组装受到严格的大脑发育时空变化调控。脑内调控学习与记忆的是哪些内源NMDA受体,它们在大脑中的占比是怎样的,它们的组装形式和已知的异源重组受体是否存在差异,系列问题极大限制了对突触分子功能的理解。
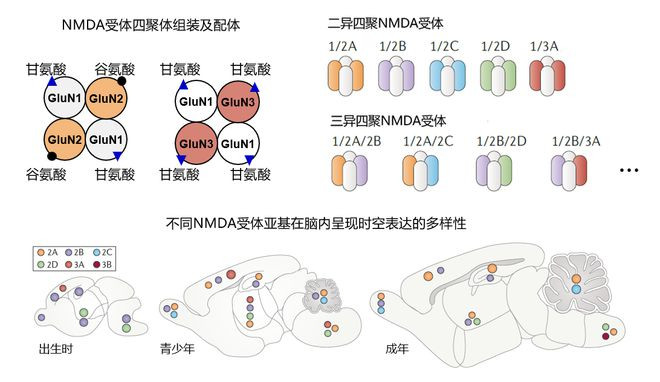
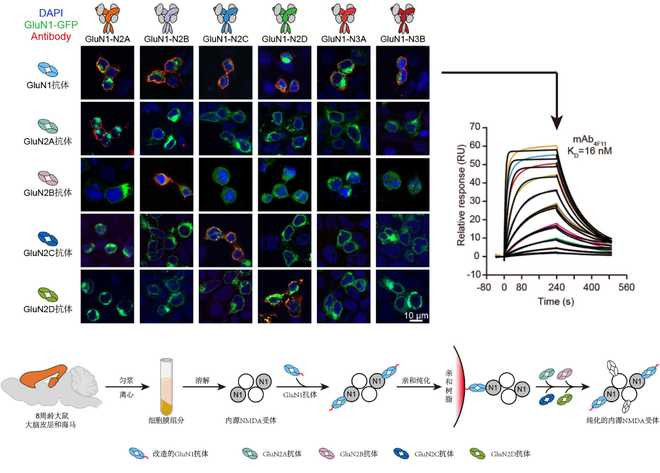
为了从脑组织中分离出内源NMDA受体,竺淑佳团队通过多年的技术积累,定制了靶向各个NMDA受体亚基的构象特异性单克隆抗体。团队通过异源重组表达的不同NMDA亚型蛋白逐一免疫小鼠,通过杂交瘤技术及活细胞染色筛选出了靶向NMDA受体各亚基的选择性单抗。借助这些实验室自制的超高亲和力抗体工具(亲和力在纳摩尔数量级),研究团队成功从成年大鼠的大脑皮层和海马中富集和分离出了丰度极低的内源NMDA受体。
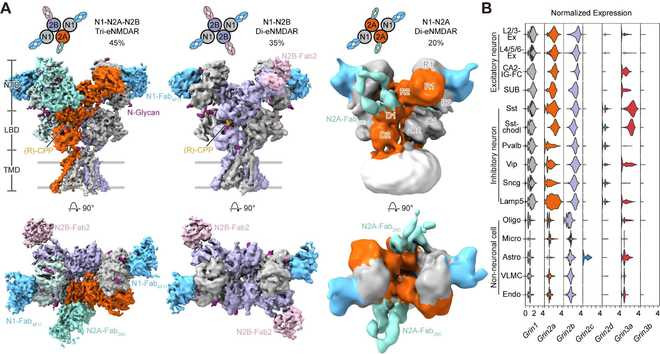
通过冷冻电镜(cryo-EM)技术,团队从皮层和海马中的内源NMDA受体解析出了3种主要的受体亚型:GluN1-N2A-N2B三异四聚体,GluN1-N2B和GluN1-N2A二异四聚体,分别占据45%,35%和20%的比例。该研究表明GluN1-N2A-N2B三异四聚体是内源丰度最高的亚型,强调了GluN2A和GluN2B亚基在生理状态同一受体中的功能整合。更新了领域内三十年来认为发育关键期(developmentalswitch)是从GluN1-2B转变为GluN1-2A的观点,应修正为从出生时GluN1-2B转变为成年的GluN1-2A-2B,GluN1-2B和GluN1-2A三种亚型共存的结论。
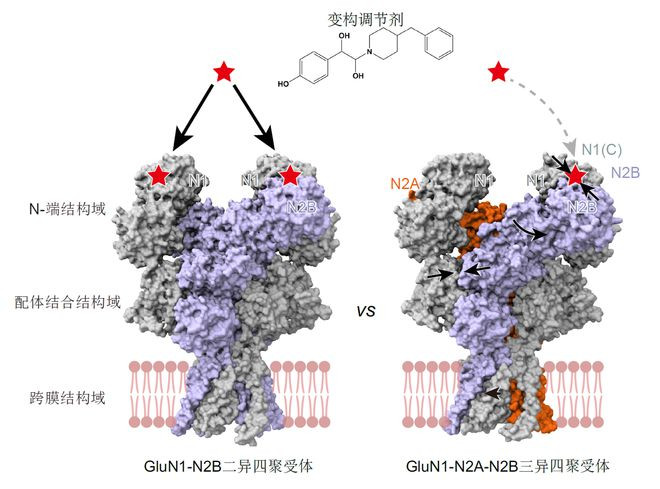
研究团队进一步通过结构对比发现了GluN2B亚基在GluN1-N2A-N2B三异四聚体和GluN1-N2B二异四聚体中的构象区别,揭示了同一亚基在不同受体中存在构象差异,将决定不同亚型的生物物理学、药理学和通道开放属性。不同内源NMDA受体间的构象差异,为理解内源NMDA受体的功能多样性,以及不同受体的药理差异提供了分子基础。该发现为设计具有亚基特异性且具有亚型偏好性的化合物提供了可能,有助于提高NMDA受体药物的靶向性。
该研究范式突破了几十年来NMDA受体的分子结构局限于体外异源重组表达系统的瓶颈,首次在原子分辨率上“看到”调控哺乳动物学习和记忆的“分子开关”的精细结构,揭示了内源NMDA受体的组装和组成,不仅加深了神经科学领域对NMDA受体介导的突触可塑性、学习和记忆等生理功能的理解,更为后续研究基于NMDA受体功能障碍相关脑疾病的机制和治疗,揭示靶向NMDA受体临床药物的在体作用机制奠定了重要的理论依据。